Cetoacidose Diabética: detalhamentos avançados para tratamento
Compreenda a cetoacidose diabética, como reconhecê-la e trata-la, de acordo com as diretrizes mais eficientes

- No post de hoje, discutiremos e desmistificaremos a cetoacidose diabética, uma temida conhecida dos Pediatras.
- Dentre os diversos temas abordados, discutiremos sua fisiopatologia, as diferentes classificações, quais são os exames laboratoriais efetivos e como realizar o manejo clínico corretamente.
Isso é particularmente verdadeiro nos setores de urgência e emergência — e um dos motivos pelos quais criamos o PortalPed foi justamente ajudá-los nesses momentos. Na hora da urgência, ter esquematizado mentalmente o passo a passo para a boa condução do paciente com determinada doença é fundamental. Em geral, para as doenças mais prevalentes, isso é quase automático.
A cetoacidose diabética (CAD), no entanto, é uma daquelas doenças mais do que indesejadas. Grave e pouco prevalente, sempre precisamos pegar nossos livros/anotações para relembrar sua condução. Por isso, preparamos esse resumo sobre o tema, discutindo seus pontos principais e trazendo, de maneira clara e atualizada, tudo o que você precisa saber sobre a CAD.
QUAL A IMPORTÂNCIA DE RECONHECERMOS E TRATARMOS A CAD?
A acetoacidose diabética é descrita, via de regra, como uma complicação de pacientes portadores de diabetes mellitus tipo 1 (DM1) e é frequentemente a forma de apresentação — isto é, a primeira manifestação — dessa doença.
Não existem sinais patognomônicos que a identifiquem, e naqueles pacientes sem diagnóstico prévio de DM seu reconhecimento pode ser ainda mais difícil. Pior ainda: dados apontam que a incidência é inversamente proporcional à prevalência de DM1 na população de determinado local — ou seja, quanto menos casos de DM1 temos, menos pensamos em CAD e mais criamos condições para que ela se instale. Essas taxas são, portanto, bastante variáveis, oscilando entre 15–70% nos países europeus e na América do Norte. [1]
Apesar da descrição da CAD ocorrer a priori em DM1, ela pode também ser a apresentação inicial de DM2. Estudos epidemiológicos mostram que cerca de 4% das crianças aborígenes no Canadá abrem o quadro de DM2 com CAD. Esse número sobe para 25% das crianças e adolescentes irlandesas e, nos EUA, chega a 30% das mexicano-americanas e 40% das afro-americanas obesas. [2]
Para nossa sorte, apesar da diferente fisiopatogenia destas duas apresentações, tanto a CAD propiciada pelo DM1 quanto a desencadeada pelo DM2 são manejadas da mesma forma.
CETOACIDOSE: COMO É QUE ELA ACONTECE?
Detalhes sobre a fisiopatologia da CDA
O primeiro passo para o reconhecimento da CAD e tratamento precoce é entendermos como ela se desenvolve e como se apresenta.
A fisiopatologia da CAD, bem como do DM1, se inicia com a falta de insulina (completa ou em quantidade insuficiente para a manutenção das funções metabólicas normais) e, consequentemente, o bloqueio da entrada de glicose nas células.
Em situações normais, as células utilizam a glicose como combustível para a geração de energia (ATP). Quando os níveis de glicose no sangue caem (como em situações de jejum ou de exercícios físicos extenuantes), mecanismos regulatórios são ativados, aumentando os níveis de glucagon e dos ditos hormônios de estresse (ex.: adrenalina e cortisol), que atuarão em vias alternativas de geração dessa energia, como a glicogenólise, a gliconeogênese e a lipólise.
O tecido adiposo e os lipídios constituem uma importante fonte de armazenamento de energia em nosso corpo. A lipase — enzima que quebra os lipídios em ácidos graxos e gliceróis — também tem sua atividade regulada por esses hormônios. Enquanto a insulina inibe sua atividade, o glucagon a promove. Isso significa que, em situações pós-prandiais normais, quando há abundância de glicose circulante e liberação de insulina pelo pâncreas para sua utilização pelas células, a insulina bloqueia a atividade da lipase, impedindo a quebra das gorduras para geração de energia. Por outro lado, em situações de jejum ou de grande demanda energética, há liberação de glucagon pelo pâncreas e a ativação dessa enzima, iniciando-se a lipólise.
Enquanto os gliceróis são destinados à produção de novas moléculas de glicose, os ácidos graxos livres são transportados até o fígado onde, nas mitocôndrias dos hepatócitos, sofrem um processo de β-oxidação e serão transformados em acetilcoenzima A (acetil-CoA). Em pacientes não diabéticos, o acetil-CoA junta-se ao oxaloacetato, um derivado do piruvato (por sua vez derivado da glicose) e é utilizado no ciclo de Krebs para a geração de moléculas de ATP. [3]
No entanto, nos pacientes diabéticos, em que não há entrada de glicose nas células, o oxaloacetato é desviado para a produção de novas moléculas de glicose (gliconeogênese). Sem o oxaloacetato, as moléculas de acetil-CoA se acumulam e não dão entrada no ciclo tricarboxílico, tendo sua utilização desviada para a formação de corpos cetônicos. Uma enzima chamada tiolase catalisa a reação inicial, unindo duas moléculas de acetil-CoA para formar uma molécula de acetoacetato (AcAc). O AcAc pode sofrer espontaneamente uma descarboxilação e se transformar em acetona. Também pode ser reduzido em 3-hidroxibutirado ou β-hidroxibutirato (BHOB) pela enzima 3-hidroxibutirato desidrogenase, recebendo um elétron e transformando-se nesse outro ácido. Nesta etapa, NADH é oxidado em NAD+ (uma reação redox). [4] Essas três substâncias são o que chamamos de corpos cetônicos e são aproveitadas como fonte de energia para diversos tecidos do corpo, como músculos, cérebro e coração, locais em que são novamente transformadas em acetil-CoA e utilizadas como fonte de energia no ciclo de Krebs e na cadeia fosforilativa.
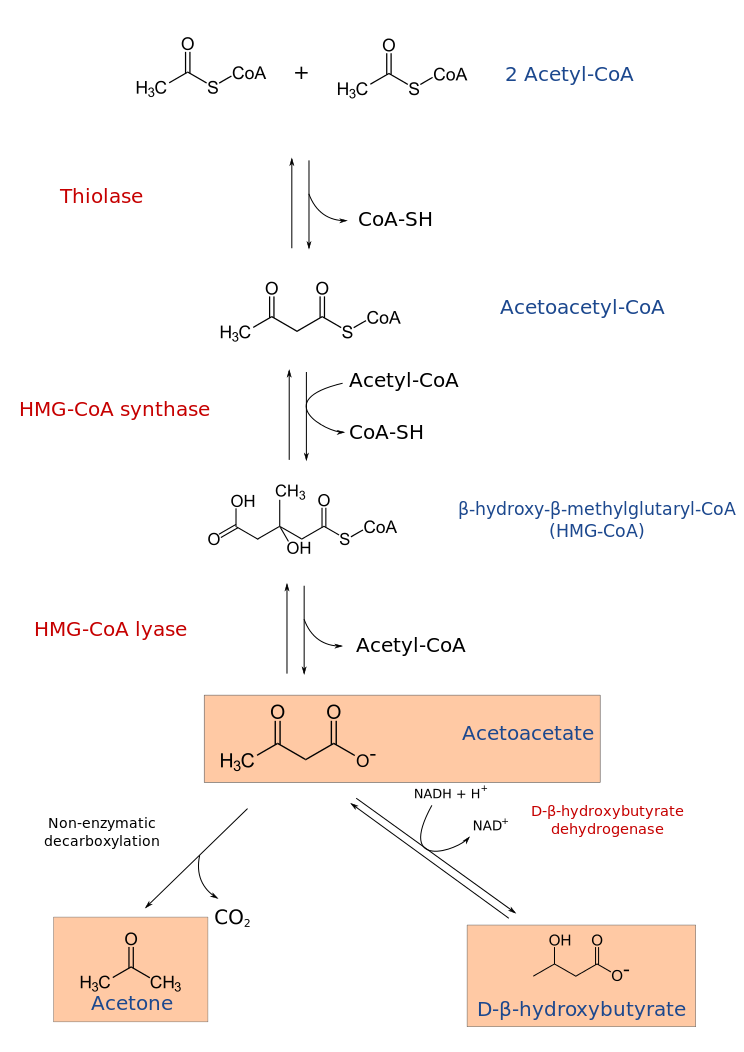
A razão entre BHOB e AcAc no sangue é dependente do potencial redox (isto é, da relação NADH/NAD+) nas mitocôndrias dos hepatócitos. Tal potencial encontra-se aumentado na CAD, favorecendo o desvio de AcAc para BHOB.
Em situações normais, temos uma relação entre AcAc e BHOB de 1:1. Na CAD, essa relação é descrita como de 3:1, podendo chegar até 10:1. [5]
Enquanto a acetona é inócua para o pH, os outros dois corpos cetônicos são ácidos fortes, reduzindo o pH sanguíneo e promovendo acidose.
O excesso de glicose no sangue, muitas vezes concomitante a um aumento dos níveis de ureia circulantes (pois há intensa utilização de aminoácidos para a produção de novas moléculas de glicose), eleva a osmolaridade sanguínea, promovendo o efluxo de água de dentro para fora das células. Os níveis aumentados de glicemia, por sua vez, excedem o limite renal de filtração (em geral de no máximo ≈200 mg/dL de glicose), promovendo diurese osmótica e perda de grande quantidade de água pela urina (com desidratação subsequente). [1]
APRESENTAÇÃO CLÍNICA DA CETOACIDOSE DIABÉTICA
Fatores de risco e sinais de alerta
Nos pacientes com diagnóstico prévio de DM1, qualquer alteração no seu padrão metabólico normal nos faz pensar que a CDA possa estar se desenvolvendo. Entretanto, conforme a explicação no início deste post, em até 70% dos casos (e isso em países desenvolvidos!) não temos essa “dica” inicial e precisaremos suspeitar clinicamente dessa doença.
A CAD é descrita como “um estado de desidratação hiperosmolar”. Como visto acima, a desidratação é obrigatória nesse estado. Mas, para nossa infelicidade, ela nem sempre é fácil de ser percebida clinicamente. A perda crônica de líquido tanto do compartimento intra quanto do extracelular faz com que os sinais clássicos de desidratação (como mudanças no turgor ou afilamento de pulsos) não estejam presentes ao exame físico, não sendo impossível que passe despercebida pelo pediatra caso não se esteja buscando por essa informação. [1]
Outras alterações secundárias à desidratação, como a taquicardia e a taquipneia, também são comuns. Queixas de dor abdominal em pacientes que já se comunicam, bem como a presença de náuseas e vômitos, são outras apresentações frequentes dessa patologia. Em estados mais avançados, alterações neurológicas — como cefaleia, irritabilidade, confusão mental, sonolência, letargia e até mesmo coma — e alterações no ritmo respiratório, com o padrão típico de estados de acidose metabólica (ritmo de Kussmaul), podem estar presentes.
É comum, também, o relato de cheiro de acetona (um cheiro adocicado, às vezes também descrito como o de “fruta em decomposição”) no ambiente em que se atende o paciente com CAD. [2] História de polis (poliúria, polidpsia e polifagia) é comum nesses pacientes, mas não uma condição sine qua non. São pouco frequentes (ou até mesmo ausentes) naqueles muito pequenos e que ainda se encontram em fases pré-verbais do desenvolvimento, que não se queixarão de fome ou sede, ou nos quais os pais podem não perceber um aumento do volume e frequência urinários (dependendo da regularidade com que fazem a troca de fraldas). Não obstante, são as crianças pequenas, em geral menores de 2 anos, que constituem a população de maior risco para o desenvolvimento de CAD.
A perda de peso, seja pela lipólise, seja pela desidratação, é um achado marcante da presença dessa doença, mas depende-se de uma informação precisa e confiável dos pais quanto ao peso anterior para sua constatação. [1]
Nos pacientes sabidamente portadores de DM1, a má adesão ao tratamento com insulina, a necessidade paulatina de aumento de suas doses, a presença de problemas familiares, antecedentes psiquiátricos, baixo nível socioeconômico e dificuldade de acesso a serviços de saúde constituem fatores que podem levar mais frequentemente ao desenvolvimento de CAD. No entanto, história prévia de recorrências de episódios de CAD parece ser um dos principais fatores de risco para isso. [2] Um grande estudo retrospectivo conduzido em Denver, Colorado (EUA), constatou que 60% dos casos de CAD ocorreram em apenas 5% das crianças diabéticas, sendo que aqueles com história de quatro ou mais episódios somavam 35% de todos os casos. [6]
DEFINIÇÃO DE CETOACIDOSE
Critérios fisiológicos e laboratoriais
Uma vez entendida a fisiopatologia e apresentação clínica da doença, fica fácil entendermos os critérios para definição de CAD:
- Hiperglicemia: é a consequência primária do DM e causa principal da desidratação. É a parte “diabética” do nome da patologia.
- Cetose: ocorre pela formação de corpos cetônicos para a obtenção de energia pelo organismo.
- Acidose metabólica: consequência da grande produção de corpos cetônicos, muito além de sua capacidade de metabolização pelos tecidos. A formação de ácido láctico em decorrência da desidratação também pode ocorrer. A presença de todos esses ácidos no sangue leva à diminuição do seu pH — ou seja, à acidose.
Sendo assim, os critérios laboratoriais da CAD são:
- Hiperglicemia: glicemia ≥200 mg/dL (11 mmol/L);
- Cetose: há duas formas de constatação: a presença de corpos cetônicos na urina (duas ou mais cruzes) e a medida de cetonemia (BHOB ≥3 mmol/L ou 31 mEq/dL). [1]
- Acidose metabólica: pH venoso <7,3 ou bicarbonato <15 mEq/L (15 mmol/L);
Aqui, uma importante explicação se faz necessária. As fitas urinárias utilizadas para a detecção de corpos cetônicos apenas identificam o AcAc e a acetona. Ora, como explicado anteriormente, a produção de BHOB está aumentadíssima na CAD, em níveis que podem chegar até 10:1 em relação ao AcAc, sendo ele o principal responsável pela cetonemia e acidose. Dessa forma, a detecção do AcAc na urina pode:
- Não estar tão fortemente presente, ainda que o BHOB já tenha níveis elevados;
- Dar a falsa impressão, na evolução, de que a cetose está se resolvendo, embora a maior parte dos corpos cetônicos eliminada (na forma de BHOB) não seja detectada pelo método;
- Erroneamente sugerir que o quadro de CAD ainda esteja vigente, pois ainda eliminamos ácidos por horas na urina mesmo quando ela já tenha se resolvido. [1]
Existem no mercado diversos aparelhos comerciais de medida da cetonemia, que funcionam como os glicosímetros. A maioria desses modelos, de fato, medem tanto a glicemia capilar (o famoso “dextro”) quanto a cetonemia, necessitando apenas de fitas reagentes diferentes.
CLASSIFICAÇÃO DA CETOACIDOSE
Quando ela é considerada leve, moderada ou grave?
Dependendo do grau de acidemia dos exames, podemos classificar a CAD de três formas:
- Leve: pH venoso <7,3 ou bicarbonato <15 mEq/L (ou mmol/L)
- Moderada: pH <7,2 ou bicarbonato <10 mEq/L (ou mmol/L)
- Grave: pH <7,1 ou bicarbonato <5 mEq/L (ou mmol/L) [1]
Obviamente, os casos mais graves são aqueles que demandarão mais cuidados, e os casos leves podem efetivamente ser conduzidos de maneira mais particular (vide seção “Tratamento” mais à frente). No entanto, tais classificações normalmente possuem pouca importância na prática clínica.
Estima-se, de maneira subjetiva e inacurada, que os quadros leves apresentem desidratação de <5% da volemia, os moderados de 5–7% e os graves de 7–10% da volemia. Apesar disso, choque é raro em crianças com CAD. [1]
PERDAS ELETROLÍTICAS
Outra característica importante da CAD: além da perda de água, do excesso de glicose e da formação de ácidos, o paciente irá, necessariamente, sofrer alterações na quantidade de seus eletrólitos, em geral para menos.
Todos os eletrólitos estão passíveis de depleção, sendo os mais importantes o sódio e o potássio. As perdas estimadas de sódio e potássio nesses pacientes são, respectivamente, de até 5–13 mEq/kg e 6–7 mEq/kg (os valores mudam conforme a fonte de referência). No entanto, independentemente das perdas em potencial, laboratorialmente falando, a apresentação desses desbalanços podem ser muitas, divergindo de hipo a normal e hiper variações.
Sódio
Como dito anteriormente, a glicose, altamente restrita ao espaço extracelular, provoca um fluxo de água do LIC para o LEC, levando a uma hiponatremia dilucional. Por isso, é importante corrigir o valor medido de sódio conforme a glicemia para uma estimativa mais acurada do pool de sódio no organismo. A seguinte fórmula é usada para isso:
Na corrigido = Na medido + 2 [(glicose sérica em mg/dL – 100)/100]
Assim, conforme o tratamento ocorre com a reposição de fluídos e a administração de insulina, a concentração de glicemia cai e a de sódio aumenta naturalmente — e o valor de sódio corrigido pela glicemia deve vagarosamente cair. Dessa forma, é importante sempre se ter em mente que um aumento no valor do sódio na progressão do tratamento não indica uma piora do estado hipertônico.
Entretanto, devemos nos atentar às taxas de mudança de sódio. Por um lado, aumento muito lento ou queda nos valores desse eletrólito e, por outro, aumento muito rápido, ambos podem ser sinais de edema cerebral. O paciente deve, assim, ser avaliado frequentemente e a terapia reanalisada para possíveis ajustes necessários. [1]
Potássio
À semelhança do sódio, a hipertonicidade do LEC promove efluxo de água e potássio de dentro das células, o que também ocorre durante a proteólise e a glicogenólise. Outro processo que provoca efluxo de potássio de dentro das células é o próprio aumento do pH: o excesso de prótons na acidose é trocado, ao nível da membrana celular, por íons K+. A correção do potássio pelo pH se dá pela seguinte fórmula:
K corrigido = K medido + 4 (7,4 – pH medido)
Juntamente da água, há perda urinária de potássio, fenômeno potencializado pelo hiperaldosteronismo que se instala nesses pacientes, secundário à depleção de volume intravascular. [1]
Outros eletrólitos
Existem alterações em outros eletrólitos também, como fosfatos, cloretos, cálcio e magnésio, mas em menor grau que os dois primeiros e, de maneira geral, pouco expressivas. As alterações, quando existem, se resolvem espontaneamente ao longo do tratamento. Alterações graves, no entanto, podem ter sua correção necessária.
Particularmente importante é o cloreto. Conforme se dá o tratamento, que em geral requer o uso de soluções ricas em cloro, seus níveis podem se elevar a ponto dele por si causar acidose (a famigerada acidose hiperclorêmica). Apesar de não representar risco potencial importante ao paciente, essa acidose pode confundir a eficácia do tratamento do CAD e levar a mudanças desnecessárias em sua condução. [1]
QUAIS EXAMES LABORATORIAIS SÃO ÚTEIS?


Está gostando desse texto?
Cadastre-se gratuitamente no PortalPed para ler o restante da matéria!

