Líquor: o que Todo Pediatra Deve Saber
A coleta do líquido cefalorraquidiano é um procedimento frequente em crianças. Tem indicação principalmente na suspeita de meningite e na febre sem sinais de localização nos menores de 3 meses. Analisaremos abaixo desde seu sistema de produção e reabsorção, até as indicações e contraindicações para coleta, interpretação e possibilidades diagnósticas.
O líquor, também chamado de líquido cefalorraquidiano (LCR) ou cérebro-espinhal, é produzido nos plexos coroides presentes nos ventrículos, principalmente nos laterais, e circula através desses ventrículos e espaço subaracnóideo (entre a aracnoide e a pia-máter) no encéfalo e medula espinhal [1,2]. Ele é um ultrafiltrado do sangue e é composto basicamente de cloreto de sódio e glicose. O balanço entre produção e absorção é que permite a manutenção da pressão intracraniana em torno de 10 mmHg. A taxa de produção do LCR é de aproximadamente 20 ml/h e nos adultos seu volume total é de cerca de 150 ml. Dessa forma, ele é totalmente renovado em aproximadamente 8 horas [3]. A sua principal função é a de proteção mecânica do sistema nervoso central (SNC). Como o cérebro tem massa de cerca de 1,5 kg, quando é envolto de líquido ele “pesa” entre 50 e 100 g. Isso é explicado pelo princípio de Arquimedes: “um corpo imerso em líquido torna-se mais leve”.
A Circulação Liquórica
O LCR circula nos ventrículos laterais, 3º ventrículo (localizado no diencéfalo) e 4º ventrículo (localizado anteriormente ao cerebelo). Os forames são os responsáveis pela passagem do líquor entres os ventrículos ou destes para o espaço subaracnóideo. O forame de Monro ou interventricular permite a passagem do líquor dos ventrículos laterais para o 3º ventrículo. O forame de Sylvius ou aqueduto cerebral permite a passagem do líquor do 3º para o 4º ventrículo. Depois do 4º ventrículo, o líquor passa para o espaço subaracnóideo e circula nesse espaço em torno da medula espinhal e do encéfalo. O forame de Magendie (localização medial) permite a passagem do líquor do 4º ventrículo para o espaço subaracnóideo da medula espinhal. Já os forames de Luschka (localização lateral) permitem a passagem do líquor do 4º ventrículo para o espaço subaracnóideo do encélafo [1,2]. A absorção desse líquido é feita nos vilos aracnoides, localizados principalmente no seio sagital superior [1,2,3].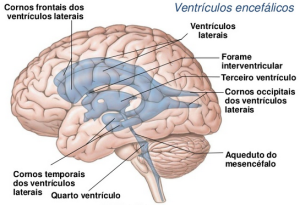

A coleta
A coleta de líquor geralmente é realizada por punção lombar ou mais raramente punção suboccipital. Independente do local de punção, sempre deve ser realizada com material adequado. Na prática diária isso ainda não é uma realidade e a utilização de agulhas tanto de tipo como de tamanho inapropriados é rotina em muitos hospitais no Brasil. O recomendado é a agulha espinhal com espessura de 22 Gauges, com comprimento apropriado para idade [4]. O comprimento sugerido é:
- <2 anos – 1,5 polegadas (1 e 1/2″ (polegadas) = 3,75 cm)
- 2 até 12 anos – 2,5 polegadas (2 e 1/2″ (polegadas) = 6,25 cm)
- >12 anos – 3,5 polegadas (3 e 1/2″ (polegadas) = 8,75 cm)
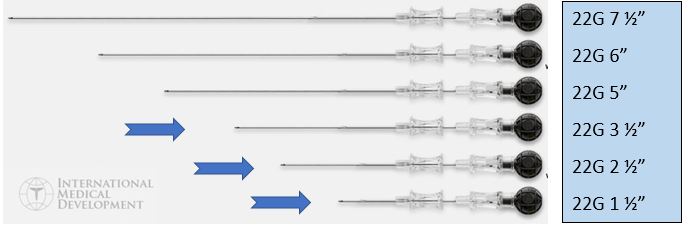
Ressaltamos que podem ocorrer variações a depender do tamanho da criança.
Além da agulha adequada, lembre-se de tranquilizar os pais e a criança antes da coleta, realizar analgesia adequada (sugerimos lidocaína 1% sem epinefrina e creme anestésico tópico EMLA – Lidocaína e Prilocaína) e avaliar se há necessidade de sedação para o procedimento. Esses são passos essenciais para que a execução seja bem sucedida. O creme anestésico tópico pode ser utilizado desde recém-nascidos e deve ser aplicado preferencialmente uma hora antes do procedimento [4].
As principais indicações para coleta do líquor estão listadas abaixo [4]:
- Suspeita de infecção do sistema nervoso central;
- Febre sem sinais localizatórios nos lactentes < 3 meses;
- Hemorragia subaracnóidea, após realização de tomografia computadorizada, quando o diagnóstico ainda for duvidoso;
- Leucemias e linfomas (estadiamento e tratamento)
- Avaliação de várias condições neurológicas desmielinizantes e granulomatosas (Síndrome de Guillain-Barré e esclerose múltipla, por exemplo);
- Remoção de líquor no tratamento da hipertensão intracraniana idiopática (pseudotumor cerebral).
As principais contraindicações para o procedimento estão listas baixo [4]:
- Aumento de pressão intracraniana com risco de herniação – caso o exame neurológico demonstre sinais focais, postura em decorticação ou descerebração, anisocoria, alteração do reflexo óculo-cefálico, Glasgow <13 ou queda de 2 pontos em relação ao mesmo exame inicial. É importante realizar tomografia de crânio e fundo de olho (para avaliação de papiledema) antes do procedimento, para estabelecimento de risco;
- Diátese hemorrágica – não realizar a punção lombar em pacientes com alteração da coagulação e que tenham sangramento ativo e/ou trombocitopenia grave (plaquetas abaixo de 50.000 ou INR > 1,4), sem correção prévia dessas anormalidades;
- Instabilidade cardiopulmonar;
- Infecção da pele e ou anexos no local da punção;
- Tríade de Cushing (bradicardia, hipertensão arterial e alteração do padrão respiratório).
A decisão de realizar uma punção lombar deve ser avaliada caso a caso. A tomografia normal não exclui completamente a presença de aumento da pressão intracraniana e não garante que isso não ocorrerá nas horas subsequentes, dependendo da patologia de base. No entanto, a punção lombar pode ser considerada dentro de seis horas após uma tomografia computadorizada normal caso não haja nenhuma outra contraindicação.
Análise do Líquor
A análise laboratorial do líquor permite a obtenção de informações importantes que permitirão definir diagnósticos e condutas terapêuticas. Sua análise consiste essencialmente na avaliação bioquímica, citológica e microbiológica.
1.Análise Bioquímica
1.1 Proteinorraquia
Os valores considerados normais para coleta lombar estão listados abaixo [5,6,7].
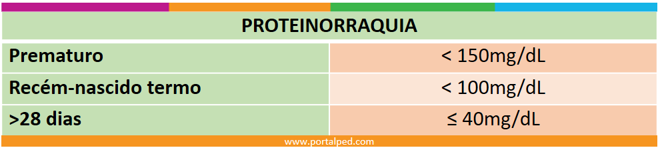
Principalmente em recém-nascidos prematuros ou a termo existe grande variação na literatura quanto aos valores considerados normais. Assim, para adequada interpretação do resultado do LCR, essa informação deve ser analisada junto com os outro parâmetros.
A concentração de proteína do LCR pode aumentar quando houver trauma na coleta. Isso ocorre por causa da maior concentração de proteínas no plasma, além de um aumento da liberação de proteínas a partir de lise de hemácias do sangue [8]. Em crianças com punção lombar traumática, a concentração de proteína do líquor pode ser corrigida subtraindo-se 1 mg /dL para cada 1.000 hemácias/microL [8,9].
Se coletado via ventricular, o valor normal de proteínas no líquor em crianças >28 dias é ≤25 mg/dL.
Os níveis aumentados de proteínas podem ser causados por:
- aumento na permeabilidade da barreira hematoencefálica;
- diminuição da reabsorção pelos vilos aracnoides;
- obstrução mecânica do fluxo do LCR;
- aumento na síntese de imunoglobulina intratecal.
As principais patologias responsáveis por hiperproteinorraquia são: meningoencefalites, tumores do SNC, neuropatia periférica diabética, bloqueio espinhal por tumor de medula, hemorragia subaracnóidea e hérnia de disco.
Por outro lado, as principais patologias responsáveis por hipoproteinorraquia são: hipertensão intracraniana, leucemias, hipoproteinemia (proteína sérica inferior a 4 g/dL) e hipertireoidismo.
O teste de Pandy é um teste semiquantitativo no qual o fenol reage com proteínas, principalmente as globulinas. Assim, ele é positivo quando há aumento da proteinorraquia. A contaminação do líquor com sangue pode acarretar falso-positivo.
1.2 Glicorraquia
Valores considerados normais de glicorraquia pela faixa etária [10]:

O valor da glicorraquia também é muito variável nos recém-nascidos com ou sem meningite, assim seu valor não deve ser interpretado de forma isolada [10,11,12]. A relação entre a glicorraquia e a glicemia não é útil em recém-nascidos com doença grave (a glicose sérica pode ser aumentada após o estresse ou a administração de glicose intravenosa antes do momento da avaliação) [10].
Nas crianças maiores de 28 dias de vida, os valores normalmente se encontram entre 50 e 80 mg/dL, cerca de 60% dos valores plasmáticos [11,13].
Hipoglicorraquia é um dado característico nas meningites bacterianas, tuberculosas e fúngicas. Alguns casos de meningocefalite viral levam a níveis baixos de glicorraquia, porém em um grau mais discreto. Encontramos também como causas de hipoglicorraquia: sarcoidose, carcinomatose meníngea e hemorragia subaracnóidea. A hiperglicorraquia, por sua vez, não possui significado clínico.
1.3 Clororraquia

Os níveis liquóricos de cloreto variam de 690 a 780 mg/dl ou de 120 a 135 mmol/L (=mEq/L). As variações da taxa de cloretos do LCR estão em íntima relação com os distúrbios de osmolaridade extracelular, que podem ser causados por vômitos, sudorese e por outras perturbações do equilíbrio hidrogênico-iônico.
São alguns exemplos de causas de:
Hiperclororraquia: meningites virais ou bacterianas, algumas doenças neurológicas e alterações renais.
Hipoclororraquia: meningite tuberculosa.
1.4 Lactato no Líquor

A elevação do lactato no LCR está relacionada ao aumento do metabolismo anaeróbio da glicose e à acidose tecidual no sistema nervoso central. O seu aumento no LCR não está relacionado à concentração sanguínea. Geralmente o lactato liquórico encontra-se elevado nas meningites bacterianas e fúngicas, no infarto cerebral agudo, na hemorragia cerebral e na encefalopatia herpética [Manual Fleury]. Existem, entretanto, poucos estudos em crianças e adultos que comprovem sua utilidade na prática diária.
2. Análise Citológica
2.1 Coloração
A coloração do líquor depende do número de células presentes.

2.2 Celularidade
A celularidade normal do LCR varia na literatura, mas os valores mais aceitos são considerados abaixo [10,11,14,15,16,17,18]

Quando ocorre acidente de punção, há limitação na interpretação do exame. Quando o LCR não é francamente hemorrágico, subtraímos 1 leucócito para cada 500-1.000 hemácias/microL. No entanto, nenhuma fórmula para “corrigir” a contagem de leucócitos no LCR pode ser utilizada com confiança total e excluir meningite quando o líquor é acidentado [19,20]. As crianças com líquor hemorrágico alterado devem ser tratadas presumidamente para meningite bacteriana e deve-se aguardar o resultado da cultura do LCR para confirmação. Muitas vezes esquecidas, as hemoculturas podem, em até 80-90% dos casos, evidenciar a bactéria responsável pela meningite [21].
Nas meningites bacterianas, o clássico é o aumento de celularidade, geralmente >1.000 leucócitos/mm3 com o predomínio de células polimorfonucleares (neutrófilos). Porém, nas fases iniciais da meningite viral (12-48 horas), podemos encontrar esse achado, principalmente se houver pleocitose baixa acompanhada de proteinorraquia pouco elevada e glicorraquia normal. Nesse caso, uma recoleta de LCR após 8-24 horas pode mostrar a viragem da celularidade para predomínio linfomonocitário [11,21].
No recém nascido, 15% das meningites bacterianas ocorrem após bacteremia [10]. Nesta faixa etária os sinais e sintomas mais comuns são: irritabilidade (60%), letargia, hipoatividade, tremores, espasmos e convulsões (20-50%) [22,23]. O achado de fontanela abaulada (25% e rigidez de nuca (15%) são raros no momento da apresentação inicial da meningite neonatal [24,25].
Algumas patologias como neurocisticercose, esquistossomose, toxoplasmose, amebíase, coccidioidomicose, toxocaríase e equinococose podem acometer o sistema nervoso central, ocasionando aumento de eosinófilos no LCR. Outras situações que levam a hipereosinofilia no LCR são as meningites eosinofílicas idiopáticas, as hemorragias subaracnóideas e as mielografias. Três parasitas (Angiostrongylus cantonensis, Baylisascaris procyonis e Gnathostoma spinigerum), que tem o homem como hospedeiro incidental, são descritos também como causa de meningite eosinofílica [26].
3. Análise Bacteriológica
3.1 Bacterioscopia pelo Gram
A coloração de Gram é o método de coloração utilizado para diferenciar espécies bacterianas em dois grupos: o das Gram positivas e o das Gram negativas. A coloração ou não das bactérias ocorre devido a composição e propriedades químicas e físicas das paredes celulares. Esse dado nos sugere qual bactéria pode estar ocasionando a infecção.
A positividade da bacterioscopia pode variar de acordo com o agente etiológico:
- 90% Streptococcus pneumoniae
- 86% Haemophilus influenzae tipo B
- 75% Neisseria meningitidis
*Quando o exame é realizado por profissionais bem treinados, a sensibilidade pode chegar a 60-90% e a especificidade próxima de 100%.

Existem outras técnicas de coloração como Ziehl-Neelsen (detecção de bacilos álcool-ácido resistentes – BAAR) que são utilizadas para bactérias que coram mal com o Gram, por exemplo a Mycobacterium tuberculosis.
As etiologias mais frequentes de meningoencefalites pela faixa etária e/ou situação clínica estão listada abaixo [Recomendações da Sociedade de Infectologia Pediátrica e da Sociedade de Cuidados Intensivos Pediátricos da SPP]:
- Recém-nascidos: S. agalactiae, E. coli, L. monocytogenes, bacilos Gram negativos.
- 1-3 meses: S. agalactiae (grupo B), L. monocytogenes, enterobacterias, S. pneumoniae, N. meningitidis, H. influenzae.
- 3 meses – 5 anos: N. meningitidis, S. pneumoniae e H. influenzae.
- Maiores de 5 anos: N. meningitidis e S. pneumoniae.
Situações especiais:
- Derivação ventriculoperitoneal: S. epidermidis, S. aureus, P. aeruginosa, enterobactérias e Enterococcus sp.
- Fístula liquórica: S. pneumoniae e H. influenzae.
3.2 Tinta da China
Coloração com “tinta da china” objetiva a pesquisa direta do fungo Cryptococcus neoformans com contraste de campo escuro em microscopia óptica.
3.3 Cultura viral, bacteriana ou fúngica, Látex e Reação em cadeia de Polimerase (PCR)
A coleta de um frasco a mais de LCR é prudente e visa o envio de material para cultura viral, bacteriana ou fúngica, pesquisa de antígenos (ensaio imunoenzimático, anticorpos fluorescentes), testes de anticorpos específicos e/ou culturas de micobactérias, fungos e parasitas. Devemos lembrar de direcionar o exame, a depender das hipóteses diagnósticas [27]. A técnica de PCR pode ser utilizada para detecção de Enterovírus, Poliovírus, Coxsackievírus dos grupos A e B, Echovírus e Herpesvírus, entre inúmeros outros. A definição etiológica das meningites assépticas pode chegar até a 60% com esta técnica. A aglutinação pelo Látex (teste imunológico) tem sensibilidade variável: S. pneumoniae (65 a 71%), H. influenzae (88 a 95%), S. agalactiae (97%), N. meningitides (64% com especificidade de 98%).
Lembramos que a utilização prévia de antimicrobianos reduzem a menos de 50% as chances de detecção etiológica pelo Gram ou pela cultura. O LCR pode ficar estéril em 90-100% dos casos após 24 a 36 horas de antibioticoterapia adequada.
A meningite asséptica é a inflamação das meninges, com pleocitose linfocítica e nenhuma causa definida após colorações e culturas rotineiras do LCR. Os vírus são a causa mais comuns. Outras causas podem ser infecciosas ou não infecciosas. As meningites assépticas devem ser revistas, especialmente com o objectivo de identificar as entidades tratáveis [28]. As principais causas de meningite asséptica são:
- Infecções bacterianas – meningite bacteriana parcialmente tratada, infecção bacteriana com um foco parameníngeo (cérebro ou abscesso epidural), tuberculose;
- Infecções virais – Enterovírus, Herpesvírus (Herpes simples, Epstein barr, Citomegalovírus, Herpes Tipos 6 e 7), Arboviroses, Parechovirus humano, vírus da coriomeningite linfocítica, vírus da raiva, Influenza, vírus da caxumba, vírus da rubéola, varicela congênita e o vírus da Zika [29];
- Infecções por espiroquetas – Sífilis, doença de Lyme;
- Infecções parasitárias – toxoplasmose, doença de Chagas;
- Infecções por Mycoplasma e Ureaplasma urealyticum;
- Infecção fúngica – candidíase, coccidioidomicose, criptococose;
- Trauma – hemorragia subaracnóidea traumática, punção lombar;
- Malignidade – teratoma, meduloblastoma, papiloma do plexo coroide e carcinoma.

Bibliografia
1. MACHADO, Angelo B.M.; HAERTEL, Lúcia Machado. Neuroanatomia funcional. 3.ed. São Paulo: Atheneu, 2006. cap 1,4,8 e 9
2.Martin, John H. Neuroanatomia – Texto e Atlas. 4.ed. McGraw Hill, 2014. cap 2 e 3
17.Kim KS. Bacterial meningitis beyond the neonatal period. In: Feigin and Cherry’s Textbook of Pediatric Infectious Diseases, 7th, Cherry JD, Harrision GJ, Kaplan SL, et al. (Eds), Elsevier Saunders, Philadelphia 2014. p.425.
21. Charles G. Prober and Leura Dyner. In: Nelson Textbook of Pediatrics Elsevier Saunders, 19th ed, Philadelphia 2011. p 2.087-2.095
25. Nizet V, Klein JO. Bacterial sepsis and meningitis. In: Infectious Diseases of the Fetus and Newborn Infant, 7th ed, Remington JS, Klein JO, Wilson CB, et al (Eds), Elsevier Saunders, Philadelphia 2011. p.222.